Inonotus rickii
Nuovo ritrovamento in Sicilia a Rometta Marea (ME)
di Angelo Miceli e Carmelo Di Vincenzo
L’articolo completo, in forma originale, è stato pubblicato su “Micologia Toscana” Bollettino dell’Associazione Gruppi Micologici Toscani (AGMT), Anno 2021, n. 3: 45-55
Premessa
Siamo ormai abituati, anche sulla scorta dei nostri precedenti ritrovamenti riferiti ad altre
interessanti e rare specie fungine, alle numerose sorprese che il territorio messinese riserva agli studiosi di micologia: protagonista del presente contributo è Inonotus rickii, interessante specie lignicola di origine tropicale appartenente al gruppo informale dei polipori, oggetto di nostri recenti ritrovamenti, che è solita fruttificare ormai da alcuni anni nel territorio messinese.
Nei primi giorni del mese di agosto dell’anno 2019 gli autori ricevono la segnalazione della crescita di una specie fungina a conformazione quasi perfettamente globosa e saldamente attaccata al substrato: un albero vivente di Albizia julibrissin. Le fruttificazioni, ripetute negli anni successivi, consentono agli autori di effettuare numerosi accertamenti di natura macro e microscopica che uniti alla gradita ed importante consulenza della Prof.ssa Annarosa Bernicchia permettono, senza ombra di dubbio, di identificarle come anamorfi di Inonotus rickii (Pat.) D.A. Reid.
Genere Inonotus P. Karst.
Meddn. Soc. Fauna Flora fenn. 5: 39 (1879)
Al genere, la cui specie tipo è I. cuticularis (Bull.) P. Karst., appartengono sporofori annuali,
dall’aspetto fibroso, a forma di mensola, sessili o stipitati, con crescita singola o a gruppi sovrapposti. La superficie superiore è caratterizzata da colori giallo-brunastri, rossicci; può essere, a seconda delle varie specie, liscia o tomentosa, ispida o glabra. La superficie inferiore è composta da tuboli generalmente corti, difficilmente separabili dalla carne soprastante, con pori di colore biancastro, brunastro, piccoli e rotondeggianti. Il contesto si presenta da soffice-fibroso a coriaceo suberoso di colore brunastro. Le fruttificazioni, a seconda della specie, presentano, anche se non sempre, una massa miceliare rotondeggiante posizionata nel punto di attacco al substrato [Bernicchia, 2005; Miceli, 2018; Bernicchia & Gorjón, 2020]. Sistema ifale monomitico o dimitico con ife generatrici da ialine a brune, prive di giunti a fibbia; ife connettive molto ramificate in alcune specie; basidi da clavati a ellissoidali; spore lisce, subglobose, globose, ovoidali o ellissoidali a seconda della specie di appartenenza, ialine, giallastre, bruno rossicce [Bernicchia, 2005; Bernicchia & Gorjón, 2020]. Tutte specie lignicole parassite o saprotrofe con crescita su latifoglie o aghifoglie. I rappresentanti di questo genere sono agenti molto aggressivi di carie bianca che spesso porta a morte sicura la pianta ospite. Tra le specie europee maggiormente aggressive ricordiamo: I. hispidus (Bull.) P. Karst.; I. cuticularis(Bull.) P. Karst.; I. rickii (Pat.) Reid [Intini, 2002; Intini & Tello, 2003].
Inonotus rickii (Pat.) D.A. Reid
Kew Bull. [12] (2): 141 (1957)
Sinonimi
≡ Xanthochrous rickii Pat., Bull. Soc. mycol. Fr. 24(1): 6 (1908) [basionimo]
≡ Polyporus rickii (Pat.) Sacc. & Trotter, Syll. fung. 21: 270 (1912)
≡ Phaeoporus rickii (Pat.) Spirin, Zmitr. & Malysheva, Nov. sist. Niz. Rast. 40: 164 (2006)
= Ptychogaster cubensis Pat., Bull. Soc. mycol. Fr. 12 (3): 133 (1896)
≡ Ceriomyces cubensis (Pat.) Sacc. & P. Syd., Syll. fung. 14 (1): 194 (1899)
= Ceriomyces stuckertii Speg., [as ‘stuckerti’], Anal. Soc. cient. argent. 47 (6): 265 (1899)
= Ptychogaster lucidus Lloyd, Mycol. Writ. 5 (Letter 49): 699 (1917)
= Polyporus rickii f. negundinis J.E. Wright & Iaconis, Revta Investnes agrop. 9: 100 (1955)
Etimologia: dal greco ἴς, ἰνός – ís, inós = muscolo, nervo, fibra e da οὖς, ωτόϛ – oús, otós = orecchio: per lo sporoforo fibroso con l’aspetto di un orecchio [Acta Plantarum, 2021]; rickii con espresso riferimento al micologo brasiliano Johann [João] (Evangelista) Rick (1869-1946) [Patouillard, 1908].
Posizione sistematica: classe Agaricomycetes Doweld, sottoclasse Agaricomycetidae Parmasto, ordine Hymenochaetales Oberw., famiglia Hymenochaetaceae Donk, genere Inonotus P. Karst.
Descrizione Macroscopica
Sporoforo di grandi dimensioni, lignicolo, a nutrizione parassitica, patogeno ed altamente
aggressivo, causa di carie bianca. È specie annuale, con sporofori sessili, appianati, a mensola, subglobosi, irregolarmente ungulati, singoli o con esemplari imbricati. Si presenta con una doppia forma di fruttificazione: anamorfa, più frequente e teleomorfa, più rara in Europa. Per tale motivo e per maggiore chiarezza espositiva analizzeremo, nella fase descrittiva e nelle componenti essenziali, le due tipologie di fruttificazione in maniera separata, precisando che relativamente agli esemplari teleomorfi le nostre deduzioni, non essendo stato possibile esaminare lo sporoforo in tale conformazione, sono supportate dall’esame e dallo studio di quanto riportato in letteratura:
Esemplari teleomorfi
Si presentano, generalmente, in forma appianata, a mensola o irregolarmente subglobosa
evidenziando, in ogni caso, una ben distinta superficie poroide.
Superficie sterile inizialmente, soprattutto negli esemplari ancora immaturi, morbida e particolarmente pubescente, di colore bruno chiaro, giallastro, poi, verso la maturazione, ruvida e rugosa con colorazioni più marcate tendenti al bruno ruggine, bruno-rossiccio; margine ottuso, glabro, grigio-giallastro.
Superficie fertile di colore bruno, essudante, specialmente a tempo piovoso, goccioline di liquido acquoso chiaro, composta da tuboli monostratificati, più chiari del contesto, mediamente lunghi (circa 15 mm) con pori piccoli (1) 2-3 per mm, rotondo-angolosi.
Contesto inizialmente sodo, carnoso, di colore bruno, bruno-rossiccio, marrone scuro, più chiaro verso il margine, con evidenti zonature disposte in maniera concentrica.
Gambo assente [Intini, 1988; Gottlieb et al., 2002; Bernicchia, 2005; Ramos et al., 2008;
Bernicchia & Gorjón, 2020].


Esemplari anamorfi
Le fruttificazioni si presentano in forma subglobosa o, a volte, appiattita, guancialiforme, perfettamente aderenti e saldamente ancorati al substrato di crescita, prive di superficie poroide. La superficie esterna degli esemplari immaturi, appare particolarmente morbida tanto da recepire ogni minima pressione che viene evidenziata dal segno di una netta impronta, caratterizzata da peli morbidi e lunghi, vellutata, pubescente, di colore fulvo-rossastro con striature biancastre e presenza di numerose goccioline acquose più evidenti dopo precipitazioni piovose. Successivamente, verso la maturazione, tende a schiarirsi assumendo, al contempo, consistenza cartilaginea, papiracea, secca, con fessurazioni sempre più evidenti. A maturazione avanzata assume la conformazione di un ammasso bruno scuro formato da numerose clamidospore e ife vegetative che alla sezione si presentano come un insieme polveroso frammisto a numerosi filamenti di circa 3-4 cm di colore marrone-rossastro molto scuro.




Descrizione Microscopica
Esemplari teleomorfi
Sporofori con sistema ifale monomitico caratterizzato da ife generatrici a parete sottile o ispessita, ialine o bruno-giallastre, ramificate, settate, prive di unioni a fibbia, assemblate in fasci di numerosi elementi. Sete imeniali e ifali: le prime di colore bruno scuro a pareti ispessite, affusolate, diritte, con apice unico o biforcuto; le seconde affusolate, appiattite, a parete ispessita, di colore bruno scuro. Basidi tetrasporici, ialini, privi di unioni a fibbia basale, ampiamente clavati. Spore a conformazione ellissoidale o ovoidale, di colore giallo-ocraceo, bruno scuro, con pareti ispessite, misure 6-8,5 × 4,5-5,5 μm [Bernicchia 2005]. Clamidospore presenti e numerose contestualmente alle basidiospore, di forma variabile, prima ialine, poi marrone scuro [Intini, 1988; Gottlieb et al., 2002; Bernicchia, 2005; Ramos et al., 2008; Bernicchia & Gorjón, 2020].
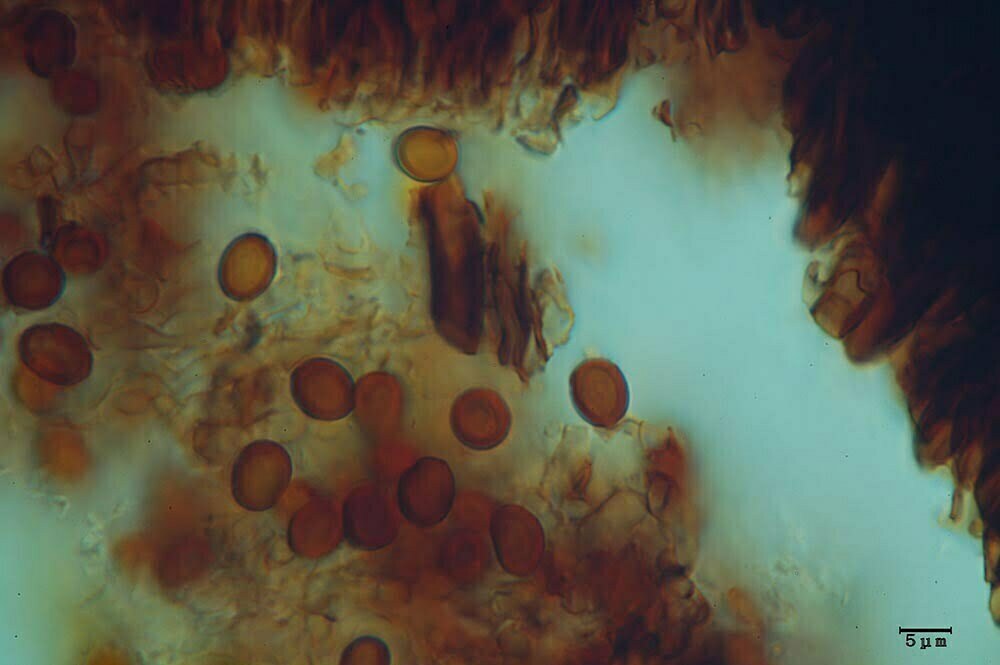

Esemplari anamorfi
Clamidospore (6,8) 8,2-11,7 (13,5) × (7,4) 8,2.10,7 (13,2) μm (Fig. 4A-B); Q = (0,9) 1-1,1 (1,3); Me = 10 × 9,6 μm; Qe = 1, a parete spessa e liscia, di conformazione globosa, subglobosa, citriniforme, a barilotto, a pera, con lunga appendice ifoide.
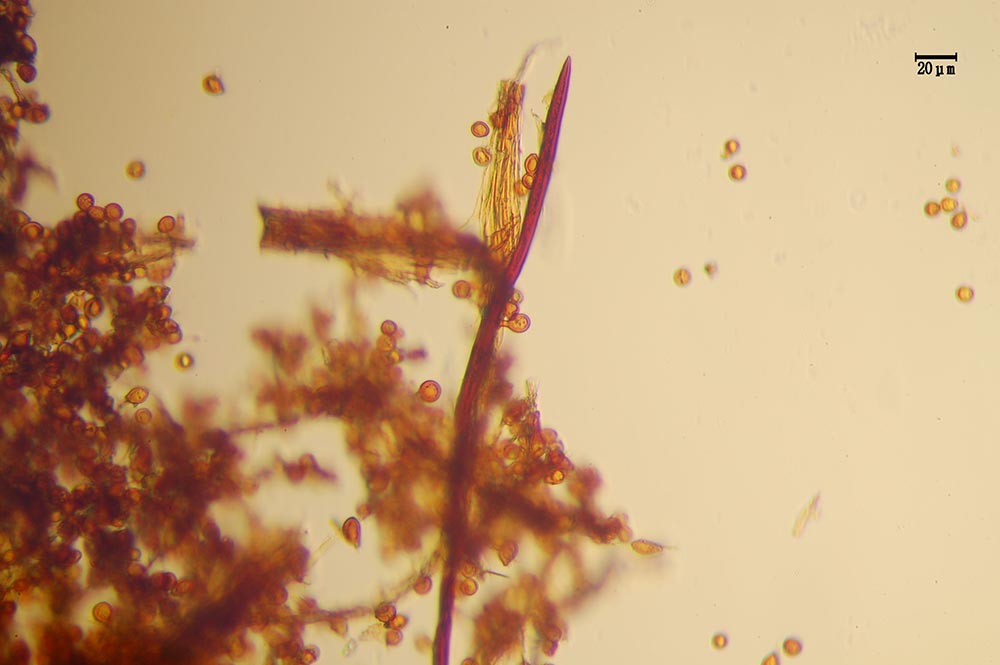
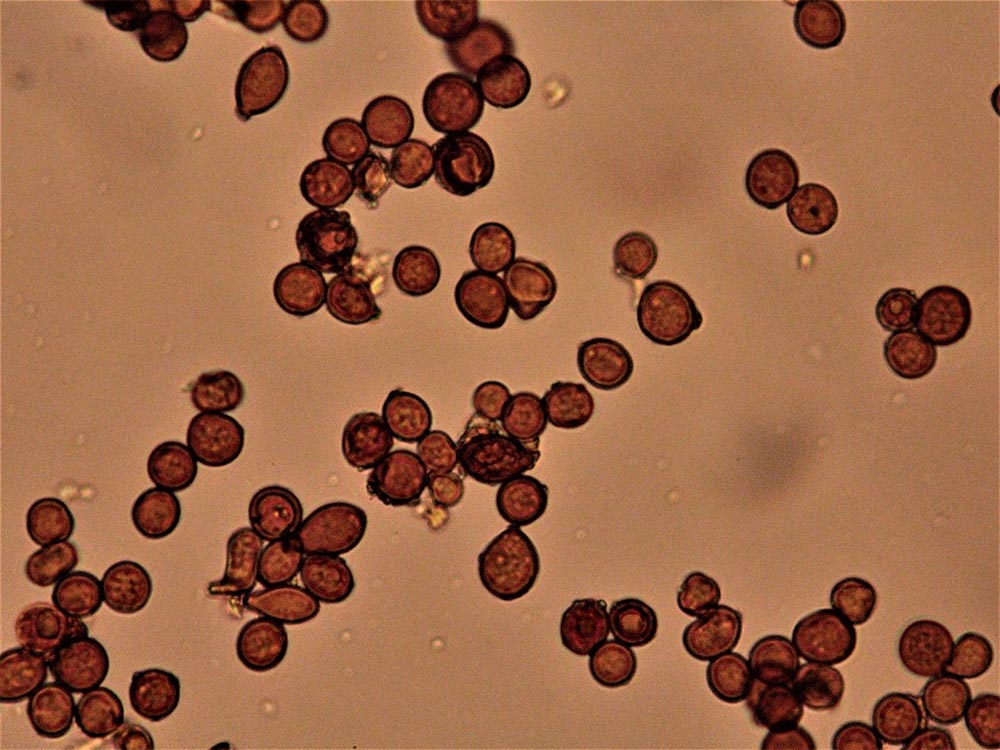
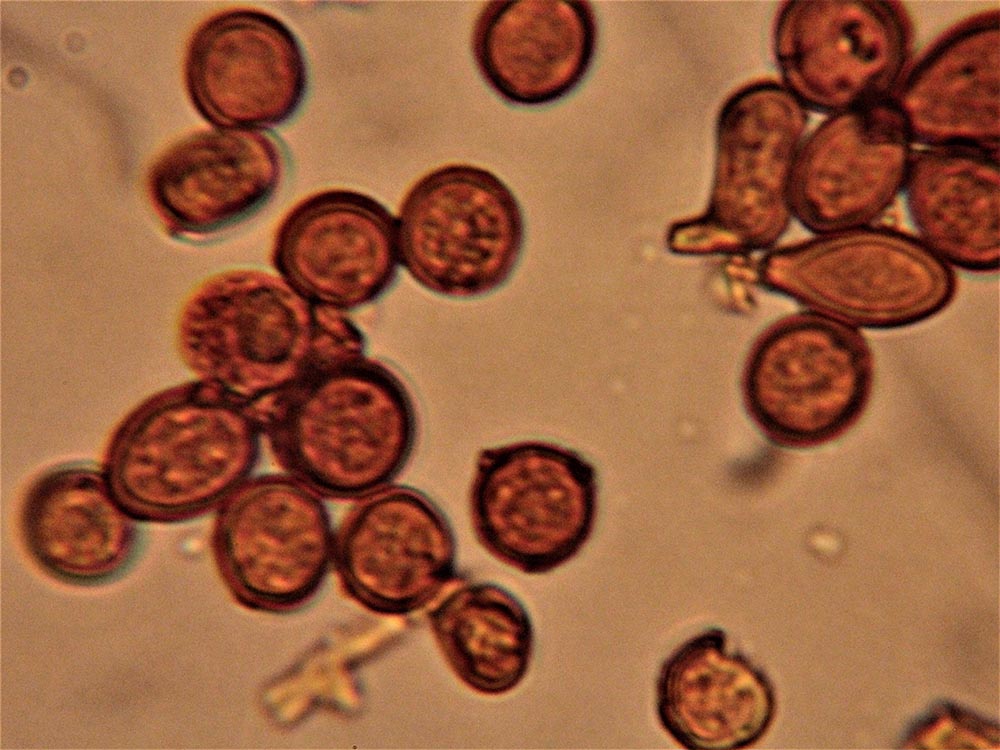
Raccolte studiate
Località Rometta Marea nel Comune di Rometta, (ME) a circa 20 m s.l.m. e a circa 250 m di distanza dalla spiaggia, nel giardino di un fabbricato adibito a civile abitazione in associazione a coltura arborea ornamentale di Albizia julibrissin , tre fruttificazioni successive ad intervallo annuale:

Prima fruttificazione: 2 agosto 2019, un solo esemplare, anamorfo, a forma subglobosa 13 × 15 cm, in corrispondenza di ferita da potatura a circa 1,80 m da terra, leg. A. Miceli e C. Di Vincenzo (segnalazione G. Galli).
Seconda fruttificazione: 5 agosto 2020, 4 esemplari sulla stessa coltura arborea, ’esemplare più grande nello stesso punto della fruttificazione dell’anno precedente, con dimensioni, conformazione e colori quasi identici; gli altri tre esemplari, sempre in corrispondenza di ferite da potatura, di dimensioni minori, subglobosi ed uno più o meno appiattito, leg. A. Miceli e C. Di Vincenzo (segnalazione G. Galli). Campioni depositati, con il numero 1148, nell’erbario dell’Associazione “Centro di Cultura Micologica” di Messina.
Terza fruttificazione: 12 agosto 2021, 2 esemplari posizionati ad altezza maggiore delle precedenti, in corrispondenza della zona iniziale delle ramificazioni, uno a forma subglobosa 14 × 16 cm, l’altro appiattito, leg. A. Miceli e C. Di Vincenzo (segnalazione G. Galli).
Caratteri differenziali
Gli esemplari teleomorfi si caratterizzano per la superficie sterile pubescente, inizialmente di colore bruno chiaro poi ruvida e rugosa con colorazioni più marcate tendenti al bruno ruggine, bruno-rossiccio e per la superficie fertile di colore bruno a tuboli monostratificati con pori piccoli e rotondi.
Gli esemplari anamorfi si riconoscono facilmente per la conformazione subglobosa, particolarmente morbida e pubescente, per il colore fulvo-rossastro con striature biancastre e, in maniera particolare, per la parte interna formata da numerose clamidospore e ife che alla rottura dell’involucro protettivo si disperdono nell’ambiente sotto forma di polvere e filamenti di intenso colore marrone-rossastro.
Modalità di riproduzione ed effetti
Considerata la tipicità delle fruttificazioni che possono presentarsi tanto in forma teleomorfa quanto in forma anamorfa, caratterizzate, quindi, dalla presenza di spore e di clamidospore, la riproduzione degli sporofori può avvenire sia in maniera sessuata sia in maniera asessuata rivestendo, quindi, un ruolo molto importante nella diffusione di patogeni molto aggressivi che infettano numerose colture arboree urbane quali, ad esempio: Parkinsonia cubensis, Sambucus nigra, Platanus acerifolia, Robinia pseudoacacia, Sapindus saponaria, Albizia julibrissin, Acer negundo, Schinus molle, Celtis australised altre ancora [Bernicchia, 2005; Mazza et al., 2008; Ramos et al., 2008].
Il patogeno si diffonde per penetrazione del micelio nella struttura dell’albero ospite attraverso lesioni o ferite spesso causate da fattori naturali o da interventi antropici raggiungendo rapidamente la parte più interna dell’albero: il durame, avviando, quindi, la degradazione dei polisaccaridi presenti nel legno.
I sintomi esterni della carie (carie bianca) si manifestano con deperimento generalizzato della pianta, avvizzimento e successiva defogliazione, disseccamento dall’alto verso il basso con andamento lento e progressivo o viceversa, dal basso verso l’alto, con andamento fulminante.
Distribuzione territoriale ed habitat
Trattasi di specie originaria dei paesi tropicali e subtropicali, ampiamente diffusa in Argentina, Brasile, Cuba, Perù, Martinica, Haiti, Isole Hawaii, Giamaica, Bahamas, Florida, Louisiana, Guadalupa, Guinea, India, Pakistan, Birmania [Intini, 1988], rinvenuta, in epoche relativamente recenti, anche in Marocco ed altri paesi dell’area del Mediterraneo: Italia, Montenegro, Creta, Francia, Spagna, Portogallo, segnalata, in quest’ultima nazione, anche a Melo et al. (2002), ex Iugoslavia, Grecia, Malta [Bernicchia, 2005; Bernicchia & Gorjón, 2020]. Inoltre è stata ritrovata in Croazia in diverse stazioni di crescita come fotograficamente documentato dal Dott. Miro Pucar [Bernicchia com. pers.]. La sua presenza in Italia, per quanto è stato possibile appurare dalla nostra ricerca bibliografica, è stata segnalata, per la prima volta in Sicilia, a Palermo all’interno di Villa Giulia su Acer negundo[Venturella & Raimondo, 2004; Bernicchia, 2005; Annesi et al., 2010] e successivamente a Catania su Sambucus nigra [Intini, 1988; Annesi et al., 2010] ed ancora, in numerosi esemplari, su Acer negundoed Albizia julibrissin, nei viali alberati dell’area urbana di Roma [Mazza et al., 2008; Annesi et al., 2010]. Il ritrovamento attuale, del quale ci stiamo occupando nel presente contributo, costituisce, quindi, un ulteriore importante conferma della presenza di I. rickii nel territorio siciliano.
È tipicamente diffusa nelle aree tropicali e subtropicali ove si associa, in qualità di parassita, a numerose latifoglie. Nella regione mediterranea europea veniva considerata specie molto rara ed oggi, nonostante diversi rinvenimenti, continua ad essere ritrovata in maniera piuttosto sporadica. Segnalata sempre su culture arboree ornamentali appartenenti ai generi Parkinsonia, Schinus, Sambucus, Albizia,Celtis tipiche di parchi, giardini e viali in aree urbane, mai nelle aree boschive, in diverse località della Spagna, Francia, Portogallo, Italia, ex Jugoslavia, Grecia, Israele, Malta [Intini, 2002; Bernicchia, 2005: Bernicchia & Gorjón, 2020]. Fruttifica in corrispondenza delle ferite degli strati corticali specialmente in quelle causate dalla potatura dei rami presentandosi soprattutto in forma anamorfa non riuscendo a riprodursi, se non in casi molto rari, nella forma teleomorfa.
Note tassonomico-nomenclaturali
Un primo ritrovamento, del quale non si ha una contezza temporale precisa, identifica in maniera errata degli esemplari di I. rickii che vengono ricondotti a Fistulina hepatica (Schaeff.) With. Successivamente, nel 1896, il micologo francese Narcisse Teophile Patouillard, sulla base di studi effettuati su esemplari anamorfi provenienti da Cuba, classifica la specie dapprima come Ptychogaster cubensis, e successivamente nel 1908 come Xanthochrous rickii. In seguito, nel 1912, i micologi italiani Pier Andrea Saccardo e Alessandro Trotter chiamano lo stesso organismo Polyporus rickii. Nel 1957, la specie viene trasferita, ad opera del micologo inglese Derek Agutter Reid, nel genere Inonotuscon la denominazione di Inonotus rickii [Calienno, 2014].
Nel 2002, uno studio di natura filogenetico-molecolare condotto da un gruppo di ricercatori conferma, sulla scia delle intuizioni di Patouillard, il legame tra la forma anamorfa di I. rickii e P. cubensisepiteto, quest’ultimo, che identifica, in maniera errata, in quanto non consentito dal Codice Internazionale di Nomenclatura per le alghe, funghi e piante (ICN) [Turland et al., 2018], proprio gli esemplari anamorfi di I. rickii, dunque un suo sinonimo [Gottlieb et al., 2002; Calienno, 2014]. È opportuno precisare che, come previsto dal Codice Internazionale di Nomenclatura per le alghe, funghi e piante, un solo epiteto binomiale identifica in modo corretto una specie fungina in tutte le sue forme anche, quindi, nella forma anamorfa [Intini, 1988; Turland et al., 2018].
Pertanto, con la denominazione di I. rickii viene identificata, in maniera corretta, tanto la forma teleomorfa quanto quella anamorfa. È ancora opportuno chiarire che il genere
Ptychogaster, descritto da Corda nel 1838, ospitante, all’epoca la sola specie P. albus Corda, venne ben presto utilizzato per accogliere specie fungine con configurazione anamorfa appartenenti al gruppo informale dei polipori [Stalpers, 2000].
Ringraziamenti
Gli Autori desiderano ringraziare la Prof.ssa Annarosa Bernicchia per il gradito supporto alla corretta identificazione degli sporofori, per la revisione del testo e per avere concesso, autorizzandone la pubblicazione, alcune foto tratte dalla sua recente pubblicazione: Polypores of mediterranean region; il Dott. Emanuele Campo (Gruppo Micologico Sacilese
– Sacile, Trento) per la consulenza di natura scientifica fornita; il micologo Franco Mondello
(Centro di Cultura Micologica – Messina) per la disponibilità ad accogliere e conservare le exsiccata nell’erbario da lui curato; Il Dott. Miro Pucar (Croazia) per avere fornito, per il tramite della Prof.ssa Annarosa Bernicchia, alcune delle foto da noi utilizzate per lo studio
della specie; il Prof. Giovanni Galli (Università di Messina) per la segnalazione relativa alla crescita degli sporofori ai quali abbiamo fatto riferimento per la presente stesura nonché per la pazienza con la quale ha sopportato la nostra continua presenza nella sua abitazione estiva che speriamo sia stata discreta e poco invadente.
Bibliografia
- Annesi T., D’Amico L., Bressanin D., Motta E. & Mazza G., 2010. Characterization of Italian isolates of Inonotus rickii. Phytopathologia Mediterranea, 49: 301-308.
- Bernicchia A., 2005. Fungi Europaei – Polyporaceae s.l. Edizioni Candusso, Alassio (SV) – I.
- Bernicchia A. & Gorjón S.P., 2020. Polypores of the Mediterranean Region. Romar Edizioni, Segrate Milano – I.
- Boccardo F., Traverso M., Vizzini A., & Zotti M., 2008. Funghi d’Italia. Zanichelli (ristampa, 2013), Bologna – I.
- Calienno L., 2014. Alterazione da funghi ed il caso di Inonotus rickii (Pat.) Reid. In “Stati di alterazione del legno e sviluppo di protocolli di indagine” Tesi di Dottorato di Ricerca di Luca Calienno. Università degli Studi della Tuscia. Viterbo – I.
- Goidànich G., 1975. Manuale di patologia vegetale. Vol. II. Edizioni Agricole, Bologna – I.
- Gottlieb A.M., Wright J.E., & Moncalvo J.M., 2002. Inonotus s.l. in Argentina–Morphology, cultural characters and molecular analyses. Mycological Progress, 1 (3): 299-313.
- Intini M., 1988. Contributo alla conoscenza dei funghi lignicoli italiani: Inonotus rickii (Pat.) Reid. Micologia Italiana, 17(1): 49-53.
- Intini M., 2002. Inonotus rickii found in Spain. Micologia e Vegetazione Mediterranea Vol XVII (1): 25-30.
- Intini M. & Tello M.L., 2003. Investigaciones sobre hongos xilófagos de árboles urbanos en Europa: primera cita de Inonotus rickii (Pat.) Reid en España. Boletin de Sanidad Vegetal. Plagas 29: 277-279.
- Mazza G., Moriondo M., Motta E. & Annesi T., 2008. Phytopatological monitoring of Inonotus rickii and GPS-GIS applications, Rome, Italy. Forest@ – Journal of Silviculture and Forest Ecology, Vol. 5: 150-170.
- Melo I., Ramos P. & Caetano M.F., 2002. First record of Inonotus rickii (Basidiomycetes, Hymenochaetaceae) in Portugal. Portugaliae Acta Biologica 20: 265-269.
- Miceli A., 2018. Inonotus hispidus. Passione Funghi & Tartufi. VI(88): 40-43.
- Patouillard N., 1908. Champignons nouveaux ou peu connus. Bulletin de la Société Mycologique de France 24(1): 1-12.
- Ramos A.P., Caetano M.F., & Melo I., 2008. Inonotus rickii (Pat.) Reid: Um importante basidomiceta lenhícola em árvores urbanas. Revista de Ciencias Agrarias 31(2):159-167.
- Stalpers J.A., 2000. The genus Ptychogaster. Karstenia 40: 167-180.
- Venturella G. & Raimondo F., 2004. I funghi cariogeni delle alberature di parchi, giardini e strade. Quaderni di Botanica Ambientale Applicata 15: 181-201.
Sitografia
Acta Plantarum (ultima consultazione, 28-03-2021). Etimologia dei nomi botanici e micologici e corretta accentazione. https://www.actaplantarum.org/etimologia/etimologia.php
- IF (ultima consultazione, 28-03-2021). Index fungorum database. www.indexfungorum.org.
- MB (ultima consultazione, 28-03-2021). Mycobank database. Fungal databases, Nomenclature & Species Banks. www.mycobank.org
- Turland N.J., Wiersema J.H., Barrie F.R., Greuter W., Hawksworth D.L., Herendeen P.S., Knapp S., Kusber W.-H., Li D.-Z., Marhold K., May T.W., Mcneill J., Monro A.M., Prado J., Price M.J. & Smith G.F. (eds.), 2018. International Code of Nomenclature for algae, fungi, and plants (Shenzhen Code) adopted by the Nineteenth International Botanical Congress Shenzhen, China, July 2017. Regnum Vegetabile 159. Glashütten: Koeltz Botanical Books. DOI https://doi.org/10.12705/Code.2018.